צפיתם בשני ניסויים וקבלתם מידע אודות נתונים כמותיים שהתקבלו
בניסויים דומים. סביר להניח כי חלק מכם ודאי הופתעו מן הנתונים הללו.
גם המדענים בסוף המאה ה-18 לא יכלו להבין תוצאות מן הסוג הזה
וויכוחים רבים התנהלו ביניהם באשר להסבר אפשרי. בנסיון להבין את
הנתונים, בוצעו ניסויים רבים עם חומרים שונים וכמה מן התוצאות
מסוכמות הטבלה הבאה:
| היסודות: (10.00 גרם מכל אחד) |
מסת התוצר מצופה: (לפי חוק שימור החומר) |
מסת התוצר בתום התגובה: (גרם) |
יסוד שנשאר בתום התגובה: |
|---|---|---|---|
| גופרית חמצן | 20.00 גרם | 20.00 | _______________ |
| מגנזיום חמצן | 20.00 גרם | 16.64 | חמצן |
| פחמן חמצן | 20.00 גרם | 13.75 | פחמן |
| חנקן חמצן | 20.00 גרם | 18.75 | חנקן |
| מימן חמצן | 20.00 גרם | 11.25 | מימן |
לכאורה נראה כאילו אי אפשר למצוא כל סדר הגיוני שיאפשר לנו לנבא את
התוצאות הצפויות מבלי שנבצע ניסויים עבור כל חומר בנפרד.
בניסיון להבין את הנתונים בטבלה, נתחיל דווקא בתגובה האחרונה,
התגובה בין מימן וחמצן:
| יסודות: | מסת התוצר בתום התגובה: (גרם) |
יסוד שנשאר בתום התגובה: (גרם) |
|
|---|---|---|---|
| a: מימן 10.00 | 11.25 | מימן 8.75 | |
| b: חמצן 10.00 | |||
 התוצר בתגובה זו הוא מים והראשון שהוכיח שניתן
התוצר בתגובה זו הוא מים והראשון שהוכיח שניתן
לקבל מים ממימן וחמצן היה המדען הנרי קוונדיש
(Henry Cavendish, 1731-1810), אשר חישב גם את
יחסי הכמויות של היסודות המשתתפים בתגובה.
קוונדיש מצא, לדוגמה, כי אם הוא מתחיל את התגובה עם
1 גרם מימן, כמות החמצן המתרכבת היא 8 גרם. כאשר
כמות המימן ההתחלתית היתה 0.5 גרם, כמות החמצן היתה
4.0 גרם, ועם 2 גרם מימן מתרכבים 16 גרם חמצן.
בתקופתו של קוונדיש לא היה הידע שיש למדענים היום ולכן אי אפשר
היה לבצע את הניסוי ההפוך, כלומר פירוק המים למריכיביהם. יתכן
שאתם, בלימודיכם הקודמים, צפיתם בניסוי כזה – האלקטרוליזה של
מים. ניסוי כזה מתואר באיורים הבאים:
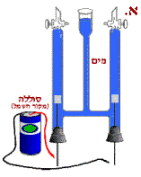 באיור א. מתוארת המערכת – כלי המורכב
באיור א. מתוארת המערכת – כלי המורכב
משלושה צינורות והוא מלא מים. בצד
התחתון של שני הצינורות הצדדיים פקקים
שבתוכם עוברים תילי מתכת המחוברים
לפיסות מתכת (אלקטרודות).
בצד מתוארת סוללה חשמלית אשר בשלב זה
אינה מחוברת לתילים.
כאשר מחברים את קצות התילים
לסוללה (איור ב.), מתפרקים המים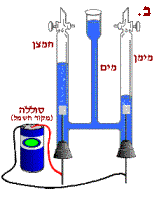
למרכיביהם – מימן וחמצן, הנאספים
בשני הצינורות הצדדיים.
ניתן למדוד את כמות המים
שפורקה, וכן את כמויות התוצרים
ולקבל נתונים הדומים לאלה
המתוארים בטבלה:
| מסת המים שפורקה: (גרם) |
מסת המימן שהתקבלה: (גרם) |
מסת החמצן שהתקבלה: (גרם) |
היחס חמצן : מימן |
|---|---|---|---|
| 10.00 | 1.11 | 8.88 | 8.88 : 1.11 = 8 |
| 20.00 | 2.22 | 17.77 | 17.77 : 2.22 = 8 |
תגובת היצירה של מים: (לנתונים נוספים הקליקו כאן)
| מסת המימן שהגיבה: (גרם) |
מסת החמצן שהגיבה: (גרם) |
מסת המים שהתקבלה: (גרם) |
היחס חמצן : מימן |
|---|---|---|---|
| 2.00 | 16.00 | 18.00 | 16.00 : 2.00 = 8 |
| 4.00 | 32.00 | 36.00 | 32.00 : 4.00 = 8 |
| 6.00 | 48.00 | 54.00 | 48.00 : 6.00 = 8 |
תגובת הפירוק של המים: (לנתונים נוספים הקליקו כאן)
| מסת המים שפורקה: (גרם) |
מסת המימן שהתקבלה: (גרם) |
מסת החמצן שהתקבלה: (גרם) |
היחס חמצן : מימן |
|---|---|---|---|
| 10.00 | 1.11 | 8.88 | 8.88 : 1.11 = 8 |
| 20.00 | 2.22 | 17.77 | 17.77 : 2.22 = 8 |
| 30.00 | 3.33 | 26.65 | 26.65 : 3.33 = 8 |
נשאלת השאלה, מדוע בכל המקרים היחס חמצן:מימן הוא דווקא 8 ולא,
לדוגמה, 8.1 או 7.9, או כל יחס אחר?
אבל זו לא היתה השאלה היחידה שהתעוררה. המדענים מצאו כי לעיתים
נוצרות תרכובות שונות מאותם יסודות. לדוגמה, היסודות פחמן וחמצן
יכולים ליצור שתי תרכובות שונות כמתואר בטבלה הבאה:
| מסת הפחמן שהגיבה: (גרם) |
מסת החמצן שהגיבה: (גרם) |
היחס מסת החמצן בניסוי 2 ————————– מסת החמצן בניסוי 1 |
|
|---|---|---|---|
| 1. | 10.00 | 13.33 | 2.00 |
| 2. | 10.00 | 26.66 |
למרות שבשני המקרים התרחשה תגובה בין אותם היסודות – פחמן וחמצן, המסה של התוצרים בכל מקרה שונה בכל אחת מן התגובות וכך גם מסת החמצן שהגיבה.
כבר בסוף המאה ה-18 היו מוכרים מקרים בהם מאותם יסודות יכלו
להיווצר תרכובות שונות. כאשר בחנו תרכובות כאלה באופן כמותי נמצאה
חוקיות מן הסוג המוצג בטבלה הבאה:
| מסת הפחמן שהגיבה: (גרם) |
מסת החמצן שהגיבה: (גרם) |
היחס מסת החמצן בניסוי 2 ————————– מסת החמצן בניסוי 1 |
|
|---|---|---|---|
| 1. | 10.00 | 13.33 | 2.00 |
| 2. | 10.00 | 26.66 |
בטבלה מתוארות שתי תגובות בין פחמן וחמצן. כאשר מחשבים את המסות
של חמצן שהגיבו בשני המקרים עם 10.00 גרם פחמן, נמצא כי היחס
ביניהם הוא מספר פשוט – במקרה זה, 2.00. (שימו לב, בטבלה זו נעשה
החישוב לגבי 10.00 גרם פחמן שהגיבו, ולא כמו בנתונים שהוצגו בטבלה
הקודמת). חוקיות מסוג זה נמצאה במקרים רבים אחרים.
הבה נסכם. בדקנו נתונים כמותיים בשני מקרים:
התגובות בין מימן וחמצן:
| מסת המימן שהגיבה: (גרם) |
מסת החמצן שהגיבה: (גרם) |
היחס | |
|---|---|---|---|
| 1. | 2.00 | 16.00 | 8.00 |
| 2. | 4.00 | 32.00 | |
| 3. | 6.00 | 48.00 |
התגובות בין פחמן וחמצן:
| מסת הפחמן שהגיבה: (גרם) |
מסת החמצן שהגיבה: (גרם) |
היחס | |
|---|---|---|---|
| 1. | 10.00 | 13.33 | 2.00 |
| 2. | 10.00 | 26.66 |


