מטרות הפעילויות:
- להפגיש את התלמידים עם חומצות ובסיסים בחיי היום- יום.
- לעורר עניין ומוטיבציה.
- להרחיב את המושגים הבסיסיים של הפרק תוך כדי לימוד עצמי ויצירת הקשרים מתאימים.
- לפתח מיומנויות חקר ומיומנויות עבודה במעבדה.
- פיתוח היכולת לעבוד בצוות, לתרום ולהיתרם.
קבוצה א' – "מסע בהרי הרוקי" – על רוק שיניים ועששת
המלצות להפעלה:
- לחשוף את התלמידים למשימה מספיק זמן מראש, אפילו תוך כדי הוראת המושגים הבסיסיים של הפרק.
- לפגוש את הקבוצה לפחות פעמיים במהלך ביצוע המשימה. רצוי שאחת הפעמים תהיה קרובה לתחילת הביצוע על מנת לוודא שהתלמידים מבינים את ההנחיות ומתכננים נכון את שלבי הביצוע.
- להדריך בקריאת מאמרים נכונה, במידה והתלמידים לא קיבלו הדרכה כזו עד כה.
- רצוי שהמורים יאספו מראש דוגמאות לפרסומות העוסקות ב- pH.
- יש להקפיד מאד על כללי בטיחות במעבדה לפני שמאפשרים לתלמידים לבצע את הניסוי שתכננו. לפני ביצוע הניסוי יש לוודא שכל אחד מחברי הקבוצה מכיר את מהלך הניסוי ואת שלבי הביצוע.
- במאמר המופיע בעיתון "על-כימיה" נפלו מספר טעויות ולכן מומלץ להשתמש במאמר המצורף.
מאמר – השפעה של לעיסת מסטיק על רמת החומציות בפה
השפעה של לעיסת מסטיק על רמת החומציות בפה – קובץ להורדה
מתוך "על כימיה" גליון 2, יוני 2002, מאת נעמי חרמוני.
המלצות לפעילויות נוספות
ניסוי – כיצד נשמור על בריאות השן? – קובץ להורדה
הוכן ע"י ורד דנגור, במסגרת הסדנה להטמעת תוכנית הלימודים החדשה, במרכז הארצי למורי הכימיה, מכון ויצמן למדע.
גומי לעיסה ועששת – מאמר לא מוכר – קובץ להורדה
עובד ע"י רוזי לייבה וגלינה גויכברג, מתוך: "ידיעון כימיה ,טכנולוגיה, חברה", חשוון 1998, במסגרת הסדנה האזורית במכון דווידסון, מכון ויצמן למדע.
מקורות:
קבוצה ב' – אבקת אפיה – כימיה במטבח
מטרת הפעילות:
- להפגיש את התלמידים עם חומצות ובסיסים הנמצאים בבית ועם תגובות חומצה בסיס שהן חלק בלתי נפרד מתהליכי בישול ואפיה.
- לעורר עניין ומוטיבציה.
- להרחיב את המושגים הבסיסיים של הפרק תוך כדי לימוד עצמי ויצירת הקשרים מתאימים.
- לפתח מיומנויות חקר ומיומנויות עבודה במעבדה.
- פיתוח היכולת לעבוד בצוות, לתרום ולהיתרם.
רקע
הרבה מאד סוגים של מאפים ולחמים הם בעלי מבנה אוורירי ונפוח. המבנה הזה נוצר מכיוון שבמהלך ההכנה והאפייה נוצר גז והתערובת תופחת. הגז הוא לרוב פחמן- דו חמצני שנוצר כתוצאה מתגובה בין אבקת אפייה ובין מרכיבים נוספים בתערובת (בדרך כלל חומציים). את הפחמן הדו-חמצני ניתן לקבל גם בתסיסה כהלית בשמרים. לפעמים הגז הוא אוויר שמוכנס לתערובת לפני האפיה ומתפשט במהלך האפייה.
החומר הפעיל בתערובת אבקת האפיה הוא הסודה לשתיה שיכול להגיב ליצירת פחמן דו-חמצני בשתי דרכים:
בחימום – 2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
בסביבה חומצית – NaHCO3(s) + H3O+(aq) → Na+(aq) + CO2(g) +2H2O(l)
התבוננות על האריזה של אבקת האפיה מגלה שההרכב שלה כולל: עמילן תירס, סודיום ביקרבונט – סודה לשתיה שהוא המרכיב הבסיסי באבקת האפיה. דו נתרן דו מימן פירופוספאט – בבדיקת חומציות יתגלה כחומצי.
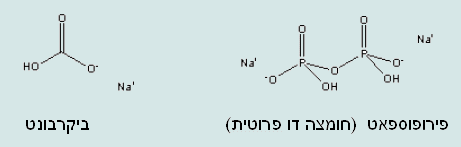
אחת מהמשימות של התלמידים היא עריכת השוואה בין כושר התפיחה של שמרים ואבקת אפיה, ניתן גם להרחיב ולהוסיף סודה לשתיה. על מנת להקל על התלמידים בתכנון הניסוי, ניתן להביא לתלמידים מתכוני עוגות הכוללים שימוש באבקת אפיה או שמרים או סודה לשתיה. (להסב את תשומת ליבם, שמתכון המכיל סודה לשתיה כחומר מתפיח יחיד כולל גם תוספת של נוזל חומצי כמו: מיץ לימון, מיץ תפוזים, חלב או יוגורט).
על מנת לקבוע את כמות השמרים ואבקת האפייה לצורך השוואת כושר ההתפחה, ניתן לכוון את התלמידים למתכונים שונים ולבדוק את כמות אבקת האפייה המומלצת או כמות השמרים המומלצת לאותה כמות של קמח וסוכר.
את הבדיקה לא חייבים לבצע בתהליך אפייה, אלא ניתן לבדוק את נפח הגז המשתחרר כשהחומרים נמצאים בתמיסה מימית מתאימה, למרות שבדיקה תוך כדי תהליך אפייה יכולה להיות נחמדה, מעניינת יותר לתלמידים ואפילו טעימה לכל הכיתה.
ניסוי הצימוקים – ניסוי מס' 7 באתר התוכנית "כימיה בגישה חוקרת"
רקע מדעי לניסוי:
בניסוי זה מוסיפים למים אבקת NaHCO3(s) ומתחילה להתרחש תגובת ההמסה:
NaHCO3(aq) → Na+(aq) + HCO3–(aq)
לאחר מכן מוסיפים את הצימוקים (והם שוקעים בתחתית הכלי) ובשלב הבא מוסיפים את תמיסת חומצת חומץ שהוכנה על-ידי המסת החומר CH3COOH(l) במים. החומר מגיב עם מים על-פי הניסוח:
CH3COOH(l) + H2O(l) → H3O+(aq) + CH3COO–(aq)
קבוע שיווי המשקל של תמיסת חומצה אצטית ב – 250°C הוא 1.8×10-5. כלומר רב המולקולות לא מיוננות.
במפגש בין החומרים בתמיסה הנתונה, מתרחשות תגובות שניסוחן:
CH3COOH(l) + HCO3–(aq) → CH3COO–(aq) + CO2(g) + H2O(l)
אפשר לנסח את התגובה:
H3O+(aq) + HCO3–(aq) → CO2(g) + H2O(l)
כתוצאה משחרור הגז CO2 בתמיסה, בועות קטנות נספחות סביב הצימוקים ומצטברות על פניהם. לכן, נפחם של הצימוקים גדל, צפיפותם קטנה, והם עולים כלפי מעלה לפני המים. שם מתפוצצות בועות הגז הכלוא והצימוק יורד חזרה לקרקעית הכלי. אם מצטברות שוב מספיק בועות סביבו, התהליך יחזור על עצמו.
במדריך למורה "כימיה בגישה חוקרת" תוכלו למצוא פרטים נוספים על הניסוי כניסוי חקר: וריאציות נוספות לביצוע, מטרות בהוראת חקר, המלצה לחלוקת זמן, טיפים מניסיונם של מורים שביצעו את הניסוי בכיתתם ודוגמאות לכיווני חקר שהוצעו ע"י תלמידים.
החלק האחרון של המשימה – חלק ד, נועד להרחבת המשימה והתאמה לרמה 3 ביחידת המעבדה.
מקורות:
- Baking Soda vs. Baking Powder
- באתר זה תוכלו למצוא נוסחאות כימיות ונוסחאות מבנה לחומרים:
http://chemfinder.cambridgesoft.com/result.asp - באתרים הבאים ניתן למצוא מדע על סוגים שונים של אבקת אפיה ואופן הפעולה שלה.
http://www.victoriapacking.com/bpowderinfo.html
Fun with Fizz
http://chemistry.about.com/od/foodcookingchemistry
Thoughtco
Paloaltoonline
http://food.oregonstate.edu/faq/janfaq/bakingpowder1.html
http://www.chemsoc.org/networks/learnnet/kitchenchemistry/docs/SS08.doc - באתר הבא תוכלו גם לצפות באנימציה אם תקליקו על "gluten animation"
Science of Bread
המלצות לפעילויות נוספות לקבוצה ב'
מעבדה – חומציות פרי הדר:
עובד ע"י ורד דנגור, שרה גונן ובתיה שר בהנחיית ד"ר יעל שורץ, במסגרת הסדנה להטמעת תוכנית הלימודים החדשה במרכז הארצי למורי הכימיה, מכון ויצמן למדע.
פעילות – ייצור יוגורט ביתי:
עובד ע"י ורד דנגור, שרה גונן ובתיה שר בהנחיית ד"ר יעל שוורץ במסגרת הסדנה להטמעת תוכנית הלימודים החדשה במרכז הארצי למורי הכימיה, מכון ויצמן למדע.
הסבר למתרחש בניסוי:
חיידקים אנאירוביים היוצרים חומצה לקטית הם אלה שגורמים להחמצה של החלב ולהפיכתו מנוזל לחצי מוצק. החלבון קזאין שנמצא בחלב משנה את המבנה המרחבי שלו בסביבה חומצית, דבר המשפיע על צמיגות הנוזל. מקור החיידקים בניסוי הוא ביוגורט שמוסיפים לחלב. משאירים את התערובת בחוץ כדי לתת לחיידקים טמפרטורה נוחה להתרבות ולפעול. בשלב מסוים יש לקרר כדי למנוע מהחיידקים להמשיך ולהחמיץ את התערובת.
פעילות – הכנת גבינת קוטג' מחלב לא טרי
קבוצה ג' – אספירין ומשככי כאבים אחרים
מטרת הפעילות:
- הכרות עם חומצה קרבוכסילית המשמשת כתרופה נפוצה.
- הכרות עם ההיסטוריה והכימיה של האספירין.
- זיהוי מעבדתי של ההבדלים בין הסוגים השונים של האספירין (מצופה, עם בופר ורגיל).
- הכרות עם תרופות משככות כאבים אחרות.
על המדפים ברשתות הפארם ובבתי המרקחת ניתן כיום למצוא מגוון של תרופות משככות כאבים מסוגים שונים שניתן לקנות אותן ללא מרשם רופא. נוכח השפע הזה עולות שאלות רבות, כמו: כיצד נבחר בתרופה המתאימה לנו? מהו החומר הפעיל המסתתר מאחורי השמות המסחריים בתרופות השונות? האם יש לתרופות הללו תופעות לוואי שראוי לנו לדעת עליהם? האם משככי כאבים הם המצאה של העידן המודרני?
החומצה הסליצילית, ממנה מיוצר האספירין, מצויה בצמחים שונים והיא דוגמה יפה לשימוש שנעשה כבר בתקופות קדומות בצמחי מרפא. היפוקרטס המוזכר בחץ הזמן של האספירין הוא הרופא שניסח את שבועת הרופאים, שאותה נשבעים הרופאים עד עצם ימינו אלה.
מנגנון הפעולה של אספרין בגוף
האספירין, אצטיל חומצה סליצילית, עלול לגרום לרגישות בוושט ובקיבה של אנשים מסוימים. האספירין מונע היווצרות פרוסטאגלנדינים המגינים על רירית הקיבה. פרוסטגלנדינים הם הורמונים הקשורים בתהליכים שונים בגוף האדם, בהם הופעת הכאב. פעילותו הרצויה של האספירין היא עיכוב הפרוסטאגלנדינים הגורמים להופעה של כאב, חום ודלקת, אך היות שהוא משפיע בשלבים הראשונים של הסינתזה שלהם, הוא מעכב את שני המסלולים – הרצוי (מניעת כאב) והבלתי רצוי (חוסר הגנה על רירית הקיבה).
טבליות אספרין משופרות
אספירין עם בופר (buffered Asperin) ואספירין מצופה (coated Asperin) אמורים לפתור את בעיית הרגישות בקיבה. החומר שמשתמשים בו בטבליות אלו כדי לאזן את החומציות של האצטיל חומצה סליצילית הוא לרוב CaCO3. הציפוי מצמצם את התמוססות הטבלייה בקיבה, שם ה-pH חומצי, ומאפשר את התמוססותה במעי הדק, שם ה-pH בסיסי חלש. הציפוי עשוי אתיל צלולוז והוא מתמוסס באופן הדרגתי כך שהאספירין שבטבליה משתחרר בהדרגה.
שמות מסחריים של משככי כאבים
שככי הכאבים הנפוצים, פרט לאספירין, מכילים אצטאמינופן (הנקרא גם פאראצטמול), כמו – תילנול, אקמול, פאראמול, דקסמול, או איבופרופן, כמו- נורופן, אדוויל ואדקס.
תשובות לחלק מהשאלות בפעילות
- א. היות שחומציות היא הגורמת לאי הנעימות בחלקים העליונים של מערכת העיכול, ושט וקיבה, היה ניתן לחשוב שיש לשנות את הקבוצה הקרבוקסילית.
- א. אספרין, אצטיל חומצה סליצילית, עבר הידרוליזה בגלל הלחות באוויר, כאשר תנאי האיחסון אינם מיטביים. מהקבוצה האצטילית מתקבלת חומצת חומץ בעלת ריח אופייני.
ב. לא, יכולת האספרין לשכך כאבים אינה תלויה בנוכחות הקבוצה האצטילית. חומצה סליצילית משככת כאבים גם היא. - ג. היינו ממליצים לאדם בעל רגישות בקיבה להשתמש באצטאמינופן כמשכך כאבים, היות שאינו מכיל קבוצה קרבוקסילית.
- קרומי התאים בנויים משכבה כפולה של פוספוליפידים. במקומות שונים משובצים בקרום גם חלבונים. תפקיד הטבעת הבנזנית ההידרופובית במולקולה של התרופות היא לאפשר חדירה שלהן דרך הקרומים אל תוך התאים.
הוראת המשימה:
המשימה היא קבוצתית, ל 4-5 תלמידים. את החלק הראשון, קטע המידע והשאלות הנלוות אליו, יכולים התלמידים להכין בבית. אם הזמן העומד לרשות הניסויים הוא מעבדה של שני שעורים רצופים בלבד, יכול כל אחד מהתלמידים לבצע סעיף אחר בניסוי ולענות על השאלות הרלבנטיות לסעיף זה. שימו לב: בסעיף ב' יש שני ניסויים. השאלות לשלושת הניסויים הראשונים מצויות לאחר סעיף ב'.
בדוח הכולל את כל שלבי העבודה יש לכלול גם את התשובות לשאלות על קטע המידע.
הציוד הנדרש לניסויים:
בליות של 3 סוגים של אספירין – רגיל, עם בופר ומצופה, שניים מכל סוג
10 כוסות כימיות של 200 סמ"ק ממוספרות
600 מ"ל מים
300 מ"ל תמיסת אבקת אפייה 15%
300 מ"ל חומץ (החומץ הנמכר במרכולים הוא של 5%)
נייר pH
חומצה סליצילית באבקה
טבלית של אצטאמינופן (אקמול, דקסמול, פראמול, תילנול)
5 כוסות
תמיסת FeCl3 1%
5 מקלות זכוכית
תוצאות הניסוי
| אספירין | אספירין עם בופר | אספירין מצופה | |
|---|---|---|---|
| מים מזוקקים | הכדור מתחיל להתפורר לפני כל הכדורים האחרים בהמשך הזמן לא רואים המשך של ההתפוררות- התצפיות לא משתנות עם הזמן. |
הכדור מתחיל להתפורר כ- 30 שניות לאחר האספירין הרגיל אך קצב ההתפוררות שלו מהיר יותר ויש שחרור של גז. שחרור הגז הוא כנראה תגובה של היון הפחמתי בסביבה חומצית המתקבלת מהיווצרות החומצה הסליצילית. עם הזמן רואים המשך של ההתפוררות, הכדור מתקלף ואפילו נשבר ושחרור הגז מפסיק. | אין תצפיות מיוחדות. לכדור לא קורה כלום גם לאחר 30 דקות. |
| חומץ | גם במקרה זה הכדור מתחיל להתפורר ראשון. בשלב די מוקדם אין שינוי בתצפיות, ז"א שמפסיקים להבחין בהמשך ההתפוררות.,תצפיות דומות לאלו שהתקבלו במים. | התפוררות ושחרור הגז מתחילים כ- 30 שניות לאחר האספירין הרגיל. כמות הגז המשתחררת גדולה יותר ומהירה יותר מזו שבמים. הכדור קופץ בתוך הכוס כנראה כתוצאה משחרור הגז. שחרור הגז נמשך זמן רב יותר מאשר בכוס עם המים, ההתפוררות מהירה יותר וניתן להבחין בגרגרי מוצק לבן שצפים על פני הנוזל. | אין תצפיות מיוחדות. לכדור לא קורה כלום גם לאחר 30 דקות. |
| תמיסת סודה לשתיה | גם במקרה זה הכדור מתחיל להתפורר ראשון.
יש שחרור של גז שהוא כנראה תוצר התגובה בין החומצה הכדור מתפורר מהר מאד, לאחר 60 שניות לא ניתן להבחין בכדור. ההתפוררות של הכדור מהירה יותר מפני שהחומצה הסליצילית באספירין מגיבה עם יוני ההידרוקסי הנוצרים בתמיסת סודה לשתיה. |
ב-90 השניות הראשונות ההתפוררות של הכדור איטית מאד וכמעט אין שחרור של גז.
אחרי דקה וחצי קצב שחרור הגז מתגבר הכדור מתחיל להתפורר ומוצק לבן צף על פני הנוזל. |
במשך 20 הדקות הראשונות ההתפוררות של הכדור איטית מאד. ניתן לצפות בשחרור גז אך מעט מאד ובקצב איטי. לאחר 20 דקות מתחילה התפוררות בקצב מהיר וקצב שחרור הגז מהיר יותר. ניתן לצפות במוצק לבן שצף על פני הנוזל. ניתן לראות שהכדור המצופה מגיב רק בסביבה בסיסית המתאימה למעי. והתגובה מתחילה כנראה רק לאחר התפוררות הציפוי. |
חלק ב'
חלק זה מתבצע לאחר התייצבות בכוסות 1-3 הכוסות המכילות מים. בשלב זה יש להעמיד כוס נוספת מס' 10 המכילה מים מזוקקים בלבד ומשמשת בקרה בבדיקת pH.
תוצאות הבדיקה:
כוס מס' 1 – מכילה אספירין רגיל pH= 6
כוס מס' 2 – מכילה אספירין בופר pH = 6
כוס מס' 3 – מכילה אספירין מצופה pH= 6.5
כוס מס' 10- מכילה מים בלבד pH= 6.5
בשני הכוסות 1, 2 ה- pH חומצי יותר בשל נוכחות של חומצה סליצילית. האספרין המצופה אינו מגיב עם מים ולכן ה- pH לא משתנה אלא נשאר כמו של המים.
חלק ג'
| מבחנה מספר | טבליה או אבקה | תצפיות לאחר הוספת FeCl3 |
|---|---|---|
| 1 | חומצה סליצילית | צבע סגול כהה |
| 2 | אספירין רגיל | על הכדור מתחילים לראות את הצבע הסגול שמתפשט עם הזמן. וכמובן את התצפיות שראינו כאשר הטבליה היתה טבולה במים. |
| 3 | אספירין בופר | צבע סגול כהה מיידי |
| 4 | אספירין מצופה | לא מופיע צבע סגול גם לאחר זמן ממושך מאד. |
| 5 | רוקל | מופיע מיד הצבע הסגול ובבדיקה של המרכיבים ניתן למצוא את החומצה אצטיל סליצילית |
הצעה לפעילות נוספת לקבוצה ג': קטע מידע נוסף על אספירין + שאלות קובץ להורדה
קבוצה ד' – קרם הגנה, ויטמין ותרופה
קרם הגנה, ויטמין ותרופה – קובץ להורדה.
מטרות הפעילות
- הכרות עם תרכובות המכילות קבוצות אמיניות.
- הכרות עם PABA (Para Amino Benzoic Acid) המשמש כקרם הגנה מפני קרינת השמש, כויטמין וכחומר מוצא לאנטיביוטיקה.
- הכרות עם המונחים: קרינה אולטרה סגולה, מקדם הגנה, סולפה.
- פיתוח מיומנות של השוואה בין מולקולות בעלות מבנה ושימוש דומה.
קרינה אולטרה סגולה ונזקיה
קרינת השמש חשובה לקיום החיים על פני כדור הארץ, אולם יש בה גם סכנה לבריאותנו. אחד מהמרכיבים של קרינת השמש הוא קרינה אולטרה סגולה (Ultra Violet – UV) אשר עלולה לגרום לנזקים קשים לעור. הקרניים האולטרה סגולות הן בעלות אורך גל קצר מזה של האור הנראה (בין 100 ל-400 ננומטר). קרינה זו יכולה לגרום לשבירת מולקולות DNA ועל ידי כך לשנות את התכונות של תאי העור החדשים שיווצרו. השינויים בתאים גורמים לכתמים, קמטים, ואפילו לסרטן העור.
קיימים שלושה סוגים של קרניים אולטרה סגולות: UV-A, UV-B, UV-C. הם נבדלים זה מזה באורך הגל. UV-A חודר דרך האפידרמיס, פוגע בדרמיס וכתוצאה מכך ניכרת הזדקנות של העור. הוא גם תורם להיווצרות סרטן העור. UV-B בעל אורך גל קצר יותר והפוטונים שלו בעלי אנרגיה רבה יותר. לכן, הם גורמים ליותר נזק, כמו כוויות וסרטן העור. UV-C בעל אורך גל קצר עוד יותר. הוא מעוכב בדרכו לכדור הארץ על ידי שכבת האוזון. הצטמצמות שכבת האוזון הופכת גם סוג זה של קרינה לבעיה שיש להתמודד אתה.
כיצד מתגונן הגוף מפני הנזקים של קרינה אולטרה סגולה?
העור מגן על עצמו מפני קרינה אולטרה סגולה בעזרת הפיגמנט מלנין. כמות גדולה של מלנין מקנה לעור את מראהו השזוף. המלנין נוצר בעור כאשר אור השמש פוגע בו, נבלע בו ומגיב עם החומצה האמינית טירוזין ליצירת מלנין. המלנין בולע את מרבית הקרינה האולטרה סגולה ומקטין את הנזקים שהיא עלולה לגרום. אצל אנשים שלא משתייכים לגזע הלבן, יצירת מלנין היא תהליך מתמשך ולכן התאים מוגנים מפני קרינה אולטרה סגולה והסכנה להיווצרות סרטן העור אצלם נמוכה יותר.
קרמים להגנה – כיצד הם פועלים?
ניתן להקטין את כמות הקרינה האולטרה סגולה הנבלעת ובכך להקטין את הנזקים בעזרת קרם הגנה מתאים. אפשר לחסום את קרני ה-UV על ידי משחה לבנה אטומה המחזירה את כל קרני האור, כמו המשחה שהמצילים על חוף הים משתמשים בה. משחה זו עשויה תחמוצת אבץ (והיא יעילה יותר מתחמוצת טיטניום TiO2 שגם בה משתמשים לעיתים). אחד החומרים הנפוצים המגן מפני קרינת השמש הוא PABA (Para Amino Benzoic Acid). ה- PABA בולע קרני UV-B. האנרגיה הנבלעת משתחררת אחר כך כפוטונים באורך גל ארוך יותר, בצורה של חום. בקרמים רבים להגנה מפני קרינת השמש מצויות תרכובות פחמן מסוג PABA יחד עם תחמוצת טיטניום. תוספת שמן למוצר נותנת אפקט של שקיפות לתחמוצת הלבנה האטומה. לעיתים מוסף פיגמנט אדום כדי למנוע את הלובן והאטימות. השמן מקטין גם את מסיסות הקרם במים ומונע כך את הסרתו מהגוף במי הים או הבריכה.
PABA הוא חומצה הגורמת לרגישות לאנשים מסוימים. נוסף על כך הוא משאיר כתמים על העור ועל בגדים. שינויים כימיים שניתן לעשות בו, כמו קישור של שרשרות ארוכות של כהלים מונעים את תופעות הלוואי הללו.
מקדם הגנה של הקרמים
קיימים קרמים עם כמויות שונות של PABA היוצרים דרגות הגנה שונות מפני השמש. מידת ההגנה קיבלה סימן בינלאומי של מקדם הגנה – SPF (Sun Protection Factor). המספר מייצג את הכמות המינימלית של UV-B שתגרום לאדמומית בעור בהשוואה לעור לא מוגן והוא מוכפל פי 10. למשל, כאשר מקדם ההגנה הוא, 10 פירושו הוא שאם המשתמש לא מקבל כוויה ללא הקרם במשך 10 דקות, הרי עם הקרם הוא יהיה מוגן במשך 100 דקות. ככל שהמספר גבוה יותר – ההגנה טובה יותר. ערכים של 2-4 מייצגים הגנה מועטה ומאפשרים שיזוף. ערכים מעל 15 מונעים שיזוף ומומלצים לאנשים בהירי עור.
PABA וויטמין B
פרט לפעילותו כמגן מפני קרינת השמש, מהווה PABA אחד מקבוצת הויטמינים B. הגוף יכול לייצר אותו מחומצה פולית ולכן לא כולם מחשיבים אותו כויטמין. (למרות שויטמין A נוצר בגוף מבטא-קרוטן וכן נחשב כויטמין וגם ויטמין D נוצר בהשפעת קרינה אולטרה סגולה מהשמש מפרו ויטמין המצוי בעור). במזון ניתן למצוא PABA בכבד, כליות, שמרי בירה, זרעים מלאים, פטריות ותרד.
PABA כאנטיביוטיקה
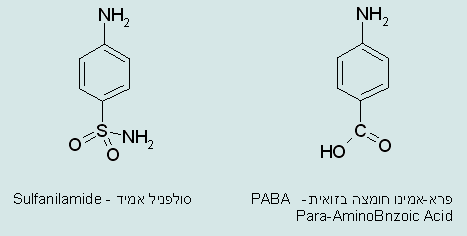
אם ה- PABA מצויה, חיידקים במעיים מייצרים ממנה חומצה פולית. תרופות מסוג סולפה, הדומות במבנה המולקולה ל- PABA (ראה איור של סולפניל אמיד) נקלטות על ידי החיידקים וגורמות למותם – עיכוב תוך תחרות או "חקיינות מולקולרית".
תשובות לחלק מהשאלות בפעילות
4. מסיסות במים היא חסרון לקרם הגנה מפני קרינת השמש. זיעה, מי-ים או בריכה יכולים לגרום לסילוקו מהמקום שעלין נמרח וכך המקום לא יהיה מוגן יותר.
5. האסטר של PABA פתר את בעיית המסיסות במים. השרשרות הארוכות הקשורות לקבוצה האמינית והקרבוקסילית הן הידרופוביות ומפחיתות את המסיסות במים.
7. טבעת בנזנית היא חלק ממבנה המולקולה של תרכובות פחמן המגינות מפני קרינה, זהו החלק במולקולה הבולע את הקרינה האולטרה סגולה.
9. החומצה הפולית היא אחד הויטמינים מקבוצה B. הוא חיוני לבניית תאים ולחילוף החומרים. חשוב לתאים המתחלקים במהירות, כמו תאי דם אדומים ותאי מערכת העצבים בעוברים. החומצה הפולית חיונית לנשים במהלך החודשים הראשונים להריון. הוויטמין מצוי בכבד ובירקות. חסר בוויטמין זה עלול לגרום לאנמיה ולפגמים במוח של ילודים.
10. השם "חקיינות מולקולרית" ניתן לאופן הפעולה של הסולפוניל אמיד בגלל הדמיון הרב במבנה המולקולות שלו לאלו של ה- PABA. חיידקים פתוגניים (גורמי מחלות) מסויימים אינם מבדילים בין שני החומרים הללו וקולטים סולפניל אמיד במקום PABA החיוני להתפתחותם. שם אחר לפעילות כזו של תרופה הוא "עיכוב תחרותי".
הצעה לפעילות נוספת לקבוצה ד' – קובץ להורדה
קבוצה ה' – אינדיקטורים
משימה נוספת שאינה מופיעה בספר התלמיד – קובץ להורדה


