- בניית מכשיר הבודק אלכוהול באוויר הנשיפה.
ההוראות לניסוי - חיטוי בעזרת אלכוהול – קובץ להורדה
כדאי לברר עם מורה הביולוגיה אם התלמידים בצעו את הניסוי במסגרת לימודי המיקרוביולוגיה.
הניסוי קל לביצוע ולא דורש מיומנות מיוחדת. - סרטון המדגים את פעולת ה"נשיפון"
- סרטון המדגים את פעולת ה"ינשוף"
- חיטוי בעזרת אלכוהול – קובץ להורדה
כדאי לברר עם מורה הביולוגיה אם התלמידים בצעו את הניסוי במסגרת לימודי המיקרוביולוגיה.
הניסוי קל לביצוע ולא דורש מיומנות מיוחדת.
מטרת הניסוי: לבדוק האם אתנול אכן מחטא את העור.
חומרים וכלים: לכל תלמיד או לכל זוג יש להכין:
צלחת פטרי עם אגר מזין
עיפרון סימון (לורד)
אתנול
צמר גפן
תרמוסטט מכוון ל- 37-40 מעלות ( אם הניסוי נעשה בעונה חמה, לא הכרחי)
מהלך העבודה:
סמנו על תחתית צלחת הפטרי המכילה את האגר חלוקה לשלוש גזרות. בגזרה אחת רשמו מים, בשניה אתנול ושלישית אל תרשמו דבר.
על מכסה צלחת הפטרי רשמו את שמכם.
הטביעו את אצבעכם על האגר בגזרה הלא מסומנת. אל תלחצו.
שטפו אצבע אחרת במים והטביעו אותה בגזרה שסימנתם. אל תלחצו.
נקו אצבע נוספת עם צמר גפן ואתנול. הטביעו באגר בלי ללחוץ.
הכניסו את הצלחות מכוסות לתרמוסטט למשך חמישה ימים עד שבוע. אם אין בנמצא תרמוסטט ניתן להעמיד את הצלחות במקום חמים.
התוצאות הצפויות:
מושבות רבות של חיידקים בשתי הגזרות הראשונות, ללא טיפול ומים, ומושבות מעטות או בכלל לא בגזרה שבה הוטבעה האצבע שנוקתה באתנול. מושבה היא קבוצת חיידקים שנוצרה מהתרבות חיידק אחד. המושבות נראות יפה לעין בלתי מזוינת, כמו שניתן לראות בתמונה.
אופן הכנה של אגר מזין:
בתוך כוס כימית יש להמס 4 גרם אבקת אגר ב-200 מ"ל מים מזוקקים. להוסיף כף גדושה אבקת מרק בשר ולחמם עד להמסה.
למזוג לתחתית (הצלחת הקטנה מבין השתיים) של פטרי את התמיסה בגובה של עד חצי ס"מ. לכסות מיד. לצנן. - עבודה עם מודלים ממוחשבים
ניתן לעבוד עם מודלים ממוחשבים באתר "כימיה והחיים"
לבחור בתפריט מצד ימין כוהלים ואז מודלים מולקולריים
בעמוד של המודלים המולקולריים, כאשר ממקמים את הסמן מעל אחד המודלים, לחיצה על עכבר ימני מאפשרת שיטות הצגה נוספות (display): מודלים ממלאי מרחב, כדור מקל וכו'. - הכרות עם כוהלים
הניסוי כולל ארבעה חלקים:
החלק הראשון עוסק במסיסות של כהלים במים. מתוך תוצאות הניסוי ניתן לראות שככל שהשייר הפחמימני במולקולת הכוהל גדול יותר, המסיסות של הכוהל במים יורדת.
בעקבות חלק זה של הניסוי ניתן לחזור על תהליכי המסה ולהרחיב:
תמיסה מוגדרת כתערובת הומגנית של מספר חומרים (לפחות שניים). תמיסות יכולות להיות במצבי צבירה שונים ולהיווצר מחומרים במצבי צבירה שונים. מקובל להגדיר את המרכיב שהוא בכמות הגדולה ביותר כממס ואת אלה שהם בכמות קטנה יותר כמומסים. חומרים כמו אתאנול, אצטון וחומצה גופרתית מתמוססים במים בכל יחס. ישנם גורמים שונים המשפיעים על מסיסות: סוג החומרים המעורבבים, טמפרטורה ולחץ.
בין מולקולות כגון מים ואתאנול פועלים קשרי מימן בנוסף לכוחות ואן דר וולס. הכנסת מולקולות קוטביות לתוך מערך קשרי המימן גורמת להפרדה של מטען חלקי חיובי במולקולה אחת ומטען חלקי שלילי במולקולה הצמודה לה. כששני החומרים קוטביים הערבוב אינו משבש את המשיכה בין הקטבים והערבוב מתאפשר.
בניסוי שלנו נצפית ירידה במסיסות עם העליה באורך השרשרת הפחמימנית במולקולות הכוהל. בניסויים אחרים העוסקים במסיסות של אתאנול במים ניתן לצפות בירידת נפח התערובת ובהתחממות הכלי.
על מנת להסביר תצפיות אלה ניתן להתייחס לנתונים התרמודינמיים הבאים עבור תהליכי המסה במים של מתאנול ואתנאול, כפי שהוצגו על-ידי יהודית זילברשטיין בהשתלמות בנושא "תרמודינמיקה" שהתקיימה במכון ויצמן. (השימוש בנתונים אלו ובהסברים הבאים בעקבותיהם לא מיועדת לתלמידים בשלב זה, ניתן לשלבם בפרקי הלימוד המתאימים בהמשך)
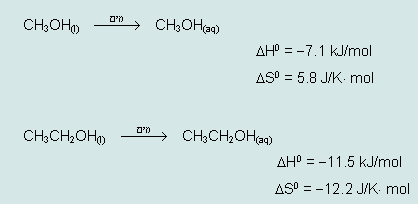
מהנתונים האלה עולות כמה שאלות:- מדוע בתהליך ההמסה של אתאנול במים נפלטת יותר אנרגיה מאשר בתהליך ההמסה של מתאנול?
- מדוע בתהליך ההמסה של מתאנול במים יש עליה באנטרופיה ואילו בהמסת אתאנול במים יש ירידה באנטרופיה?
המים הם ממס מיוחד. המים, בניגוד לנוזלים אחרים, הם נוזל מסודר. במים במצב צבירה נוזלי קשרי מימן ניתקים ונוצרים כל הזמן. כמו כן, נוצרים צברים של מולקולות הקשורות בקשרי מימן במבנה דמוי קרח. העובדה שבערבוב אתאנול ומים הנפח יורד, מוסברת ע"י כך שהשיירים הפחמימניים של מולקולות הכוהל יכולים "להתארח" בתוך החללים הקיימים באזורים דמויי הקרח. לכן כאשר מערבבים אתאנול ומים, מולקולות המים מתארגנות כך שיוכלו לארח את השיירים ההידרופוביים. מולקולות המים פונות אחת לשנייה במעטפת שעוטפת את החלק ההידרופובי. התארגנות זו מלווה בהגדלת מספר קשרי המימן בין מולקולות המים. כתוצאה מכך האנטרופיה של המערכת יורדת ונפלטת אנרגיה, כי נוצרים קשרי מימן רבים יותר בין מולקולות המים לבין עצמן. תופעה זו ידועה בשם מיום הידרופובי.
בהמסת מתאנול במים, בגלל שהשייר המתילי קטן יחסית, אין התארגנות מיוחדת של מולקולות המים ואפילו יש עליה באנטרופיה, כצפוי בקבלת תערובת.
ככל שהשייר הפחמימני גדול יותר, תהליך ההמסה דורש מידה רבה יותר של התארגנות של מולקולות המים, כך שהאקסותרמיות של התהליך אינה מפצה על הירידה באנטרופיה המסיסות במים של הכהלים הולכת וקטנה עם העלייה בגודל השייר הפחמימני, הידרופובי.אם השייר מסועף (למשל בבוטאנול שלישוני) שטח המגע עם מולקולות המים קטן יותר, לכן מידת ההתארגנות של מולקולות המים קטנה יותר לעומת 1-בוטאנול ובסופו של דבר המסיסות במים של הכוהל השלישוני טובה יותר ואילו המסיסות של 1-בוטאנול נמוכה.
להמסה היבטים רבים, רצוי להרחיב את הרקע הניתן בסיכום הניסוי בהתאם לכיווני החקר שנבחרו על ידי התלמידים.
המידע לקוח מתוך המדריך למורה "כימיה בגישה חוקרת" הבסיס המדעי לניסוי 12, "ערבוב נוזלים", ו-13 ,"קפה בארבע שכבות".החלק השני עוסק בחמצון כהלים בעזרת נחושת חמצנית.
במהלך הניסוי יש לחמם סליל נחושת ליצירת הנחושת החמצנית, שצבעה שחור. ניתן לדון בתהליך המתרחש ולהתייחס לשינויים במבנה ובדרגות החמצון.
לאחר המפגש בין הכוהל לנחושת החמצנית בולט שוב שינוי הצבע משחור, של נחושת חמצנית, לצבע האדמדם האופייני לנחושת.
ניתן לחזור על הניסוי מספר פעמים עם אותה פיסת נחושת.
ניתן להדגים בעזרת ניסוי זה את תפקידו של זרז, כי הנחושת משמשת כזרז בתהליך.החלק השלישי עוסק בחמצון כהלים באמצעות תמיסה של KMnO4. לתמיסה זו צבע סגול אופייני.
לצורך חמצון כוהל ראשוני לחומצה קרבוקסילית נדרשת כמות גדולה יותר של KMnO4 וניתן להבחין בשינוי צבע משמעותי ומהיר. לחמצון כוהל שניוני לקטון נדרשת כמות קטנה יותר של חומר מחמצן ושינוי הצבע במבחנה קטן יותר. ואילו כוהל שלישוני לא עובר חמצון ולכן לא נצפה שינוי צבע במבחנה.
כמו בהרבה ניסויים הכוללים שינוי צבע, המבחנה הרביעית המכילה מים, תמיסת KMnO4 ותמיסת חומצה, משמשת כבקרת צבע.החלק הרביעי הוא הדגמת מורה וכולל תגובה של מתכת אלקאלית עם כוהל ועם מים. תגובה של מתכת אלקאלית עם מים היא הרבה יותר אגרסיבית מאשר עם כוהל. בכל מקרה יש להקפיד על כללי עבודה זהירים במעבדה, לא לבצע את הניסוי כשהתלמידים מקיפים את שולחן המורה וקרובים מדי למערכת ללא הגנה מתאימה.
בתגובה עם הכוהל ניתן לצפות בבועה הצמודה לגוש המתכת לאורך כל התגובה.כמו בפרק ג', גם כאן ניתנות תשובות לחלק מהשאלות בספר התלמיד, מתוך הנחה שלא כל המורים מכירים את הנושא על בוריו.


