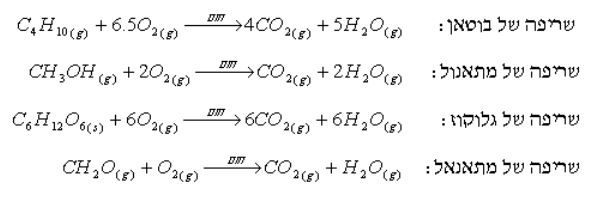משריפה מלאה של חומר אורגני, המכיל פחמן, מימן ואולי גם חמצן,
מתקבלים שני תוצרים: פחמן דו חמצני (CO2) ומים (H2O).
דוגמאות לתהליכי שריפה של תרכובות אורגניות שונות
ניתן לראות מניסוח התגובה, ללא כל קשר אם יש או אין חמצן בחומר האורגני שנשרף, כל אטומי הפחמן שהיו בתרכובת האורגנית לפני השריפה נמצאים, לאחר השריפה, בתרכובת CO2 . כמו כן, כל אטומי המימן שהיו בתרכובת האורגנית לפני השריפה נמצאים, לאחר השריפה, במים.
לכן, מתוך מסת ה- CO2 שבתוצר ניתן לחשב את מסת הפחמן ואת מסת המימן מתוך מסת המים.
לאחר שיודעים את מסת הפחמן והמימן שבתרכובת, ניתן לחשב את מסת החמצן שבתרכובת כהפרש בין מסת התרכובת לסכום מסות הפחמן והמימן.