למדענים אשר ביקשו לבודד את הנוגדנים ולחקור את הקשר בין מבנם לבין פעילותם הביולוגית היה ידוע כבר משלהי המאה ה- 19, כי הנוגדנים מצויים בסרום*[1], וכי הם מנטרלים רעלן ספציפי. אולם רק לאחר מחקרים שנמשכו כתשעים שנה הגיעו החוקרים למידע על המבנה המדויק של מולקולת הנוגדן. בפרק זה נכיר את מבנה מולקולת הנוגדן, ונדון בקשר בין מבנה זה לתפקודיה.
צעד ראשון בפענוח מבנה הנוגדן היה אפיון סוג החומר שאליו משתייכים הנוגדנים; הוכח כי הנוגדנים הם חלבונים*[2]. בסרום נמצאים חלבונים רבים. כדי לברר לאלו מבין החלבונים בסרום משתייכים הנוגדנים היה צורך להפריד בין החלבונים השונים ולברר למי מהם יש פעילות של נוגדן. ניתן להפריד את החלבונים בסרום לכמה מקטעים על פי מטענם החשמלי. ואמנם החוקרים
א' טיזליוס (A. Tiselius) וא' קבט (E. A. Kabat) הצליחו להפריד את חלבוני הסרום של ארנבת למספר מקטעים: אלבומין ועוד שלושה מקטעים של חלבונים גלובוליניים. החלבונים הגלובוליניים סומנו באותיות יווניות אלפא (α), ביתא (β), גמא (γ) בהתאם למרחק שעברו בשדה החשמלי בהשוואה לחלבון האלבומין. ראה איור 6.1.
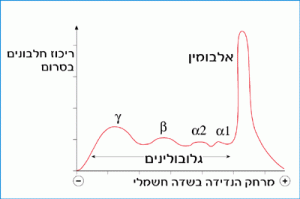
איור 6.1: תוצאות הנדידה של חלבוני סרום אדם בשדה חשמלי. השטח שמתחת לעקום מבטא את כמות החלבון בדם. שים לב, שבשיטה המתוארת באיור זה (והיא משוכללת מהשיטה שהופעלה על ידי טיזליוס וקבט) הצליחו להפריד את מקטע ה- a גלובולינים לשני תת-מקטעים (a1, a2).
איזה מקטע מחלבוני הסרום מכיל נוגדנים? בבדיקה נמצא, כי בסרום של חיה מחוסנת גבוהה כמות ה- g גלובולינים מזו שבסרום של חיה בלתי מחוסנת. האם התוספת נובעת מן העובדה שה- g גלובולינים הם נוגדנים? כדי לברר זאת נערך ניסוי נוסף. החוקרים חילקו את הסרום של החיה המחוסנת לשתי דגימות. חלבוני דגימה אחת הורצו בשדה חשמלי בלא טיפול נוסף, ואילו
חלבוני הדגימה השנייה הורצו בשדה חשמלי לאחר סילוק הנוגדנים מהסרום באמצעות השקעה עם אנטיגן. (כאמור, נוגדנים נקשרים לאנטיגן, ותוצר התגובה שוקע.) תוצאות ההרצה של שתי הדגימות הנ"ל מתוארות באיור 6.2:
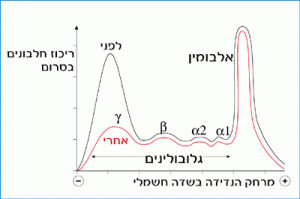
איור 6.2: תוצאות ההרצה בשדה חשמלי של סרום ארנבת ספציפי לאלבומין הביצה לפני (בשחור) ואחרי (באדום) השקעת הנוגדנים באמצעות האנטיגן הספציפי.
כדי להדגיש את תפקודם של החלבונים הגלובוליניים כנוגדנים הוחלט לכנותם אימונוגלובולינים (immunoglobulins), כלומר חלבונים גלובוליניים המשתתפים בחיסון, או בקיצור Ig. מרבית האימונוגלובולינים הם γ גלובולינים, ונקראים IgG.
מבנה מולקולת ה- IgG
קפיצת הדרך בהבנת המבנה של מולקולת הנוגדן נעשתה בשנים 1959 – 1962, בעקבות פרסום תוצאות מחקרם של ר' פורטר (Porter .R) וג' אדלמן
(G. M. Edelman). שני חוקרים אלה עסקו בפירוק מולקולת הנוגדן בשיטות שונות ובזיהוי תוצרי הפירוק. תגליותיהם זיכו אותם בשנת 1972 בפרס נובל
לרפואה ופיזיולוגיה.
פורטר פירק את מולקולת הנוגדן, באמצעות האנזים פפאין, לשני סוגים של מקטעים:
האחד שמר על היכולת לקשור אנטיגן, וכונה [3]* Fab; השני לא קשר אנטיגן, וכונה Fc.
א' ניסונוף (A. Nisonoff) נקט שיטה דומה, ופירק את מולקולת הנוגדן באמצעות האנזים פפסין. מפירוק זה התקבל מקטע אחד שמורכב משני קטעי Fab ויכול לקשור בו-זמנית שתי דטרמיננטות אנטיגניות. המקטע כונה F(ab')2. בניסוי זה ה- Fc נשבר לקטעים קטנים רבים.
פירוק הנוגדן לקטעים באמצעות אנזימים מפרקי חלבון:
פרק את המולקולה באמצעות שני "האנזימים ": פפאין (מסומן בשחור) ו פפסין (מסומן בכחול). פעולתם של האנזימים מתבצעת במקומות מסוימים. רשום במחברתך:
1. כמה סוגי מקטעים קיבלת בחיתוך עם:
א. האנזים פפאין?
ב. האנזים פפסין?
ומה שמותיהם של מקטעים אלה?
2. בכמה מקומות הצליח החיתוך עם:
א. האנזים פפאין?
ב. האנזים פפסין?
האם נקודות החיתוך קרובות או רחוקות?
אדלמן פירק את מולקולת הנוגדן בשיטה אחרת, על ידי חיזור קשרי הדו-גפרית במולקולה *[4]. תוצרי הפירוק הופרדו לפי משקלם המולקולרי. התקבלו שני סוגים של שרשרות פוליפפטידיות:
א. שרשרת קלה (light chain), שהמסה המולקולרית שלה היא כ- 25,000 דלתון *[5]. היא כונתה בקיצור L.
ב .שרשרת כבדה (heavy chain), שהמסה המולקולרית שלה היא כ- 50,000 דלתון. היא כונתה בקיצור H.
שרשרות אלה קשורות זו לזו על ידי קשרי דו – גפרית, כמודגם באיור הסכמטי שלפניך:
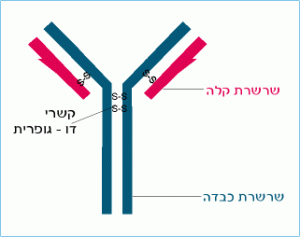
ידוע היה שהמסה המולקולרית של מולקולת ה- IgG היא כ- 150,000 דלתון. לכן ברור כי מולקולת IgG מכילה שתי שרשרות מכל סוג (150,000 = 2X )
50,000 + 2X 25,000.
לפניך איור סכמטי של מולקולת הנוגדן. פרק את המולקולה באמצעות החומר המחזר (מסומן באדום) תוצאות הביקוע של קשרי S-S (בין ציסטאינים משרשרות שונות).
בשלב זה נשאלת השאלה, מה הקשר בין מקטעי Fab ו- Fc לבין השרשרות הכבדות והקלות? פורטר ענה על שאלה זאת. הוא הזריק לעזים מקטעי Fab
או Fc שהתקבלו מטיפול אנזימטי בנוגדני ארנבת (עם האנזים פפאין) ובדק, האם הנוגדנים בסרום של העזים המחוסנות קושרים (א) שרשרות קלות; (ב) שרשרות כבדות ראה טבלה שלפניך:
| תגובה בין נוגדני עז נגד: | סוג השרשרת: בנוגדן הארנבת | תוצאות תגובת הקישור ** |
|---|---|---|
| Fab של ארנבת | כבדה | + |
| Fab של ארנבת | קלה | + |
| Fc של ארנבת | כבדה | + |
| Fc של ארנבת | קלה | – |
**הסימן + מראה שחל קישור, והסימן – מראה שלא חל קישור.
ממצאים נוספים הראו, כי קטעי ה- Fab מצויים בקצה האחד של הנוגדן (הקצה האמיני) וקטע ה- Fc בקצהו השני (בקצה הקרבוקסילי). לפניך איור סכמטי של מודל המתאר את מבנה הנוגדן:
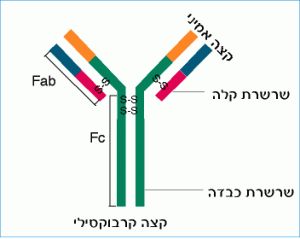
איור 6.3: תיאור סכמטי של מבנה מולקולת IgG.
באיור 6.3 ניתן לראות כי:
הקטע Fab בנוי מן השרשרת הקלה ומחלק של השרשרת הכבדה. הן קשורות ביניהן בקשרי דו-גפרית;
הקטע Fc מורכב משתי שרשרות שמקורן בשתי השרשרות הכבדות. גם הן מחוברות ביניהן בקשרי דו-גפרית.
שים לב: לנוגדן יש שני קטעי Fab וקטע Fc אחד. כיוון שנוגדן הוא דו-ערכי, עצמת הקישור בינו לבין אנטיגן (כמו נגיף או חיידק), המכיל דטרמיננטות אנטיגניות זהות רבות, גדולה בהרבה מעצמת
הקישור שיכולה הייתה להיות לו היה הנוגדן חד-ערכי.
שתי "זרועות" ה- Fab מחוברות ל- Fc באמצעות אזור הקרוי ציר. הציר מאפשר פתיחה וסגירה של זרועות ה- Fab על ידי תנועה סביבו; בהתאם לכך יכול הנוגדן לקשור שתי דטרמיננטות אנטיגניות המרוחקות זו מזו במרחקים שונים. בשיטות מעבדה מתוחכמות הצליחו לגלות את המבנה התלת-ממדי המדויק של מולקולת IgG. באיור שלפניך מוצג מודל שבו החומצות האמיניות המרכיבות את מולקולת הנוגדן מיוצגות בכדורים.
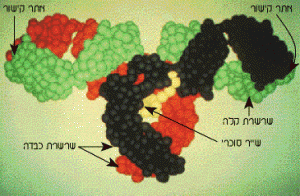
איור 6.4:מודל המתאר את המבנה התלת-ממדי של מולקולת IgG. החומצות האמיניות המרכיבות את השרשרות מיוצגות בכדורים. החומצות
האמיניות של השרשרות הקלות (L) מיוצגות בצבע ירוק; של שרשרת כבדה אחת בצבע אדום; ושל שרשרת כבדה שנייה בצבע שחור. החלק הסוכרי מיוצג על ידי כדורים שצבעם צהוב.
באדיבות פרופ' ,National Institutes of Health , D. R. Davies ארצות הברית
תפקודן של מולקולות IgG בגוף
אתר הקישור לאנטיגן נמצא בקטע Fab שבאמצעותו הנוגדן נקשר לדטרמיננטה האנטיגנית הספציפית. כאשר הדטרמיננטה האנטיגנית שאליה נקשר הנוגדן חיונית לפעילותו של האנטיגן, קישור זה מנטרל את פעילות האנטיגן. דוגמה לנטרול היא חסימת הפעילות של רעלן על ידי נוגדן; ראה איור 6.5.
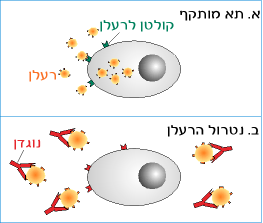
איור 6.5 : נטרול ספציפי של רעלן על ידי נוגדנים:
(א) קטע מהרעלן נקשר לקולטן המצוי בקרום התא. הרעלן חודר לתא.
(ב) נוגדן נקשר לרעלן. התוצר המתקבל בתגובה זאת אינו מסוגל להיקשר לתא, ופעילותו מנוטרלת.
דוגמאות נוספות לנטרול הן התקשרות נוגדנים לנגיפים, לטפילים ואף לחיידקים מסוימים.
מולקולת נוגדן שקשורה לאנטיגן מפעילה בדרך כלל מערכות בגוף הגורמות להרס האנטיגן. דוגמאות:
1. הפעלה של תאים בולעניים, כמודגם באיור שלפנינו:
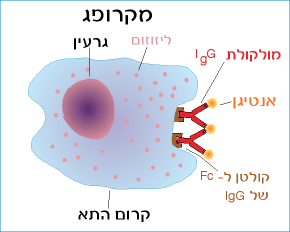
איור 6.6 : אתר מסוים בקטע Fc של נוגדן ממחלקת IgG נקשר לקולטן ל- Fc המצוי בקרום התא של מקרופג.
באיור 6.6 רואים כי הנוגדן נקשר לאנטיגן דרך אתר הקישור שבקטעי ה- Fab ולמקרופג דרך קטע Fc. הנוגדן מגשר, אם כן, בין האנטיגן לבין התא הבולעני.
2. הפעלה של מערכת המשלים. מערכת המשלים כוללת מספר חלבונים אשר מתקשרים לתצמיד נוגדן/אנטיגן. קישור זה גורם להפעלתם. החלבונים המופעלים גורמים להמסת אנטיגנים תאיים ולגיוס תאים בולעניים לאזור האנטיגן.
למולקולת הנוגדן שני תפקודים: תפקוד ראשוני – קישור ספציפי לאנטיגן; תפקוד שניוני – הפעלה של מערכות נוספות בגוף. שני התפקודים מתבצעים על ידי אזורים שונים במולקולת הנוגדן .
מחלקות של אימונוגלובולינים
לנוגדנים יש תפקודים שניוניים רבים (נוסף לאלה שהוזכרו ). מילוים קשור בהתפתחות האבולוציונית של חמש מחלקות הנבדלות זו מזו
בחלק הממלא את התפקוד השניוני. המחלקות סומנו באותיות M ,G ,E ,D ,A; ומכיוון שהאימונוגלובולינים נקראים בקיצור Ig, המחלקות השונות נקראות IgM ,IgG ,IgE ,IgD ,IgA
בהתאמה.בנוגדנים ממחלקת IgG דנו קודם . בטבלה שלפניך מסוכמות תכונות עיקריות של נוגדנים מחמש המחלקות.
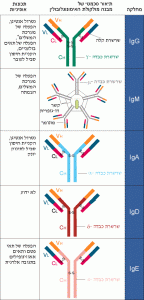
טבלה 6.2: הבדלים בין אימונוגלובולינים ממחלקות שונות. הפועלים בנוזלי גוף שונים.
נוגדנים ממחלקת IgM פועלים במערכות הדם והלימפה. הם מהווים 6% מכלל האימונוגלובולינים בסרום. הם הראשונים המופיעים בתגובה חיסונית. הם גם הראשונים שנוצרים באונטוגנזה (התפתחות הפרט מעובר לבוגר) ובפילוגנזה (התפתחות המינים). בדגים כל הנוגדנים הם ממחלקת IgM.
נוגדנים ממחלקת ה- IgA פועלים ברקמות הריריות ובחלב. הם מהווים %13 מכלל האימונוגלובולינים בסרום. יש לנוגדנים מהמחלקה הזאת מנגנון של מעבר דרך תאי אפיתל. דבר זה מאפשר להם לעבור מזרם הדם להפרשות של בלוטות הפרשה חיצונית (כמו בלוטות הזיעה ובלוטות החלב). נוגדנים ממחלקת IgA מסוגלים לנטרל נגיפים , חיידקים ורעלנים בטרם פלשו לגוף דרך מערכות העיכול, הנשימה והרבייה. הם גם מקנים חיסון סביל לתינוקות שיונקים חלב, בעיקר מפני גורמי מחלות שחודרים לגוף דרך מערכת העיכול. בחיות מסוימות, כמו כבשים, ה- IgA בחלב האם הוא המקור היחידי לחיסון הסביל של היילוד. באדם חיסון זה מוקנה בעיקר על ידי נוגדנים ממחלקת IgG, העוברים דרך קרומי התא של תאי אפיתל בשליה.
נוגדנים ממחלקת IgE נמצאים בריכוז נמוך מאוד בדמו של אדם בריא (0.002%); ריכוזם עולה אצל חולים הסובלים מתגובות אלרגיה חלק ג ומזיהומים טפיליים.
נוגדנים ממחלקת IgD נמצאים בריכוז נמוך מאוד בסרום ( % 0.1); תפקידם בסרום אינו ברור. על התפקוד הייחודי של נוגדנים ממחלקת IgD המצויים על קרום התא של תאי B נרחיב בהמשך .
לנוגדנים מהמחלקות השונות מבנה בסיסי דומה לזה של IgG . כלומר, הם בנויים משתי שרשרות כבדות זהות, אולם לכל מחלקה יש שרשרת כבדה עם
מבנה שונה. השרשרות של המחלקות השונות מצוינות באותיות היווניות המתאימות γ (גמא) ל-IgG ו- μ (מיו) ל- IgM ו- α (אלפא) ל- IgA ו- ε (אפסילון) ל- IgE ו- δ (דלתא) ל- IgD.
המבנה הראשוני של מולקולת האימונוגלובולין
מכיוון ש קטע Fab מכיל את האתר האחראי לקשירת האנטיגן, ומכיוון שמבנה אתר הקישור תלוי ברצף של החומצות האמיניות הבונות את האתר, ברור שנוגדנים בעלי ספציפיות שונה יהיו שונים במבנם הראשוני.
כזכור, קטע Fab בנוי משרשרת קלה ומחצי השרשרת הכבדה. באיזה חלק מהשרשרות הבונות את קטע Fab נמצא אתר הקישור? כדי לענות על שאלה זאת השוו החוקרים את הרצף של החומצות האמיניות בשרשרות קלות מנוגדנים שונים. תוצאות ההשוואה היו מרתקות. החוקרים הבחינו בהבדלים מובהקים ברצף של השרשרות. אולם באופן מפתיע התרכזו ההבדלים בחצי האמיני בלבד (החלק שבין החומצה האמינית הראשונה בקצה האמיני לבין החומצה האמינית שמספרה 110 ברצף). הרצפים מעבר לחומצה האמינית שמספרה 110 היו זהים בשרשרות הקלות של הנוגדנים השונים! בהתאם לממצאים אלה כונו שני החצאים בהתאמה "אזור משתנה של השרשרת הקלה", ובקיצור VL, ו"אזור קבוע של השרשרת הקלה", ובקיצור [6]* CL.
תופעה דומה נתגלתה גם בשרשרות הכבדות: גם השרשרות הכבדות בנויות מאזור קבוע ומאזור משתנה. האזור המשתנה דומה בגודלו (כ- 120 חומצות אמיניות) ובמיקומו (הוא מתחיל בקצה האמיני ) לאזור המשתנה בשרשרת הקלה. הוא כונה בקיצור VH. האזור הנותר בשרשרת הכבדה זהה במבנהו בכל השרשרות הכבדות מאותה מחלקה. הוא מכונה בקיצור CH. עיין באיור שלפניך בו מסומנים האזורים השונים של מולקולת הנוגדן בצבעים שונים: האזור המשתנה מיוצג בצבע כחול, והאזור הקבוע בחום .
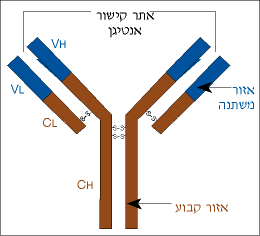
השרשרות הקלות והכבדות של מולקולת הנוגדן בנויות מאזור משתנה (VL + VH) ומאזור קבוע (CL + CH).
הנוגדנים במחלקות השונות נבדלים במבנה של האזור הקבוע בשרשרת הכבדה; נוגדנים מכיל מבחינים באזורים הקבועים Cμ, Cδ, Cγ, Cα, Cε. נוגדנים מכל המחלקות יכולים להיות בעלי ספציפיות זהה; כלומר, הם ייקשרו לאותה דטרמיננטה אנטיגנית.
הבסיס הגנטי לרבגוניות באימונוגלובולינים
מכיוון שחלבונים מקודדים על ידי גנים, ברור שהבסיס לרבגוניות של נוגדנים טמון ברבגוניות של הגנים המקדדים אותם. כדי להבין זאת נזכיר את הכללים הבאים:
כללים:
* בכל תא בגופנו יש גרעין (למעט תאי דם אדומים ותאים בשכבה החיצונית ביותר של העור), המכיל את כל המטען התורשתי (הגנום). מטען זה מוערך
בכ- 100,000 גנים.
* אף על פי שתאים שונים בגוף נבדלים במבנה ובתפקוד, כולם מכילים אותו גנום.
* גן אחד —< פוליפפטיד אחד.
על פי כללים אלה לא ברור, כיצד נוצרים כ – 108 נוגדנים מכ- 100,000 גנים. (מה עוד שגנים אלה מקדדים גם לחלבונים אחרים.)
בלימפוציטים חייבים לפיכך להתקיים מנגנונים מיוחדים המאפשרים יצירה של חלבונים רבים ממספר קטן יחסית של גנים. ממצאים שנאספו בעשרים השנים האחרונות מאמתים השערה מפתיעה זאת. הסבר מפורט של מנגנונים אלה תוכל למצוא בקטע ההרחבה שלפניך:
[1] סרום – כמחצית מנפח הדם מורכב מנוזל שמכונה פלזמה. הפלזמה היא תמיסה מימית של חומרים שונים, כמו חלבונים וגלוקוז. הסרום (serum, או נסיוב) מכיל את כל מרכיבי הפלזמה, למעט חלבונים הקשורים בקרישה.
[2] חלבון – מקרומולקולה הבנויה ממספר שרשרות פוליפפטידיות או משרשרת אחת. שרשרת פוליפפטידית אחת בנויה מחומצות אמיניות הקשורות זו לזו בקשרים פפטידיים ברצף מסוים. חלבונים בנויים מ- 20 סוגים של חומצות אמיניות. המבנה התלת- ממדי של החלבון, ולכן גם פעילותו הביולוגית, נקבעים על פי זהותן של החומצות האמיניות הבונות את החלבון ועל פי מיקומן בשרשרת. חומצות אמיניות שברצף מרוחקות זאת מזאת מתקרבות ויכולות לבנות דטרמיננטה אנטיגנית . כיצד גילו כי המבנה התלת-ממדי של החלבון נקבע על פי הרצף והסוג של החומצות האמיניות שמרכיבות אותו? כאשר שינו את המבנה התלת-ממדי של חלבון על ידי חימום או חשיפה לכימיקליים, גרמו בדרך כלל לאיבוד הפעילות הפיזיולוגית (התהליך מכונה דנטורציה ). ניתן היה להחזיר חלבון שעבר דנטורציה לתנאים פיזיולוגיים. החלבון התקפל לצורתו הטבעית, ופעילותו הפיזיולוגית חזרה. לדוגמה, כאשר החלבון שעבר דנטורציה הוא אנזים תחזור הפעילות האנזימתית. פעילות המציגה בפירוט את התהליך שבו נקבע רצף החומצות האמיניות של השרשרות הפוליפפטידיות הבונות את החלבונים השונים בגוף על פי מבנה ה- DNA . רצף של שלושה נוקלאוטידים ב – DNA , וכתוצאה מכך ב- RNA messenger ( RNA שליח), קובע את סוג החומצה האמינית המיתוספת לשרשרת הפוליפפטידית ההולכת ונבנית. חלבונים נדרשים לבנייה, לתפקוד ולבקרה של תאי הגוף, הרקמות והאברים. לכל חלבון יש תפקוד ייחודי. דוגמאות: הורמונים, אנזימים ונוגדנים.
[3] FAB- ה f מהמילה fragment (קטע) ; ab מהמלים antigen binding (קישור אנטיגן).
[4] חיזור קשרי הדו-גפרית במולקולה- חלבונים מכילים קשרי דו-גפרית (S-S) בין שני שיירי החומצה האמינית ציסטאין. קשרים אלה אפשר לפרק על ידי חומרים מחזרים.
[5] דלתון – היא יחידת מסה השווה של מסת אטום הפחמן.
[6] CL – ה V כנגד variable (משתנה), C כנגד constant (קבוע).


